Ni-NTA Magnetic Agarose Beads
Para un rendimiento alto y purificación a microescala de proteínas marcadas con His y ensayos versátiles de magnetocaptura que utilizan marcadores His
Para un rendimiento alto y purificación a microescala de proteínas marcadas con His y ensayos versátiles de magnetocaptura que utilizan marcadores His
Las Ni-NTA Magnetic Agarose Beads son partículas magnéticas recubiertas con matriz de purificación por afinidad de Ni-NTA Agarose. Se utilizan para inmovilizar y purificar proteínas recombinantes que portan un marcador His. Los residuos de histidina en la etiqueta His se unen a las posiciones vacantes en la esfera de coordinación de los iones de níquel inmovilizados con alta especificidad y afinidad. Una vez que las proteínas están unidas, las microesferas se pueden precipitar utilizando un imán y lavarse y las proteínas se eluyen en pequeños volúmenes de tampón en condiciones nativas o desnaturalizantes.
El QIAexpress Ni-NTA Protein Purification System, incluidas las Ni-NTA Magnetic Agarose Beads (consulte la figura Micrografía de Ni-NTA Magnetic Agarose Beads) se basa en la notable selectividad de la resina patentada de Ni-NTA (ácido níquel-nitrilotriacético) para proteínas que contienen un marcador de afinidad de seis o más residuos de histidina (consecutivos o alternos): el marcador His. Esta tecnología permite la purificación en un paso de casi cualquier proteína marcada con His a partir de cualquier sistema de expresión en condiciones nativas o desnaturalizantes (consulte la figura Purificación de proteínas con el sistema de purificación de proteínas Ni-NTA). El NTA, que tiene cuatro lugares de quelación para los iones de níquel, une el níquel con mayor fuerza que los sistemas de purificación por quelación de metales que solo tienen tres lugares disponibles para la interacción con iones de metal. El lugar adicional de quelación impide la lixiviación iónica del níquel y da lugar a una mayor capacidad de unión y a preparaciones de proteína con una pureza más elevada que las obtenidas mediante otros sistemas de purificación por quelación de metales. El sistema QIAexpress se puede utilizar para purificar proteínas marcadas con His a partir de cualquier sistema de expresión, incluyendo baculovirus, células de mamíferos, levaduras y bacterias.
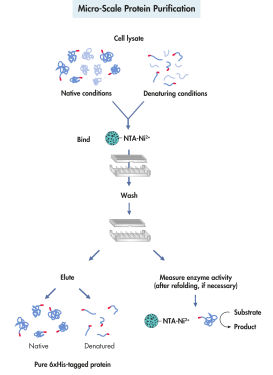
La purificación de las proteínas marcadas con His se divide en 4 etapas: lisis, unión, lavado y elución celular (consulte Purificación de proteínas a microescala). La purificación de proteínas recombinantes utilizando el sistema QIAexpress no depende de la estructura tridimensional de la proteína o el marcador His. Esto permite la purificación de proteínas en un paso en condiciones nativas o desnaturalizantes, a partir de soluciones diluidas y lisados sin procesar. Los desnaturalizantes y detergentes fuertes se pueden utilizar para la solubilización y purificación eficientes de los receptores, las proteínas de membrana y las proteínas que forman cuerpos de inclusión. Los reactivos que permiten una eliminación eficiente de contaminantes de unión no específicos se pueden incluir en tampones de lavado (consulte la tabla). Las proteínas purificadas se eluyen en condiciones suaves añadiendo 100-250 mM de imidazol como competidor o por reducción del pH.
| Desnaturalizantes | Detergentes | Agentes reductores | Otros | Sales | Para almacenamiento a largo plazo |
|---|---|---|---|---|---|
| 6 M de Gu·HCl | 2 % de Triton X-100 | 20 mM de ME | 50 % de glicerol | 4 M de MgCl2 | Hasta un 30 % de etanol |
| 8 M de urea | 2 % de Tween 20 | 10 mM de DTT | 20 % de etanol | 5 mM de CaCl2 | o 100 mM de NaOH |
| 1 % de CHAPS | 20 mM de TCEP | 20 mM de imidazol | 2 M de NaCl |
El QIAexpress Ni-NTA Protein Purification System, incluyendo las Ni-NTA Magnetic Agarose Beads, ofrece una purificación fiable en un único paso de proteínas adecuadas para cualquier aplicación, entre las que se incluyen: