✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
Waste Tubes (2 ml)
Cat. No. / ID: 19211
✓ Automatische Verarbeitung von Online-Bestellungen 24/7
✓ Sachkundiger und professioneller technischer und Produkt-Support
✓ Schnelle und zuverlässige (Nach-)Bestellung
Eigenschaften
- Qualität und Leistung der Plasmid-DNA identisch mit dem QIAprep Spin Miniprep Kit
- 15% weniger Plastik- und 15% weniger Verpackungsmaterial gegenüber dem QIAprep Spin Miniprep Kit
- Wiederverwendbare Waste Tubes aus 100 % recyceltem Kunststoff
- Pufferkonzentrate, die 48–80 % weniger Kunststoff benötigen als unsere Standardpuffer
Angaben zum Produkt
Das QIAwave Plasmid Miniprep Kit ist umweltfreundlicher als unser Standard QIAprep Spin Miniprep Kit. Das QIAwave-Kit verbraucht 15 % weniger Kunststoff und 15 % weniger Verpackungsmaterial als unser Standard-Kit, die Abfallschläuche sind aus 100 % recyceltem Kunststoff und können wiederverwendet werden. QIAwave-Puffer sind als Konzentrate erhältlich, was die Kunststoffmenge pro Flasche um 48–80 % reduziert. Um Papier zu sparen, enthält das Kit keine ausgedruckten Protokolle. Die benötigten Protokolle können aus der Ressourcenliste heruntergeladen werden. Oder scannen Sie den QR-Code im Deckel des Kits. Die Verpackung und Komponenten unseres QIAwave-Kits sehen anders aus, sind aber genauso leicht zu handhaben wie das Standard-Kit, Chemie und Leistung sind gleich.
Bitte beachten Sie, dass Sie für die Lagerung der rekonstituierten Puffer sterile Glasflaschen benötigen.
Gemeinsam mit My Green Lab haben wir die Umweltauswirkungen dieses Kits untersucht. Die ACT-Etiketten (Accountability, Consistency, Transparency) von My Green Lab bewerten Produkte nach verschiedenen Nachhaltigkeitskriterien. Das sind:
- Herstellung
- Chemikalienmanagement
- Produkt- und Verpackungsmaterialien
- Entsorgung der Verpackung am Ende des Lebenszyklus
Die Produkte werden von 1 bis 10 bewertet; der Energie- und Wasserverbrauch wird mit 1 Punkt pro kWh bzw. Gallone (3,785 Liter) bewertet. Je niedriger die Punktzahl, desto geringer die Umweltbelastung.
Sie können die ACT-Etiketten für dieses Kit im nächsten Abschnitt Ressourcen sehen.
Das QIAwave Plasmid Miniprep Kit ist für die Isolierung von bis zu 20 μg hochreiner Plasmid- oder Cosmid-DNA in molekularbiologischen Routineanwendungen, einschließlich fluoreszierender und radioaktiver Sequenzierung und Klonierung, konzipiert. Mit dem Zusatzprotokoll für hohe Ausbeuten können Sie sogar noch höhere Ausbeuten (bis zu 30 μg) erzielen. Für optimale Ergebnisse empfehlen wir, dieses Kit zusammen mit QIAvac 24 Plus zu verwenden. Und wenn zu viele Proben für die manuelle Präparation anfallen, können Sie Ihre Probenextraktion mit QIAcube Connect automatisieren.
Leistung
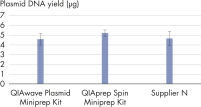
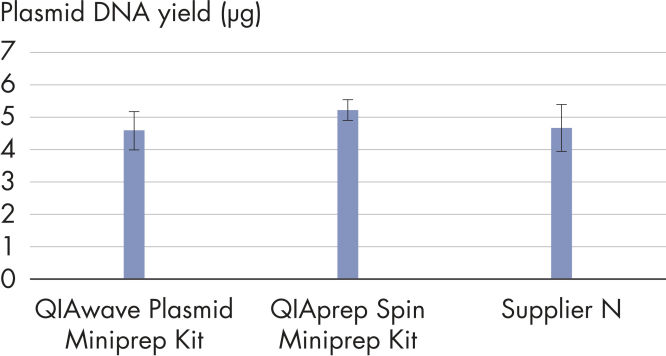
Die Leistung unseres QIAwave Plasmid Miniprep Kits und des QIAprep Spin Miniprep Kits ist identisch, da die Chemie die gleiche ist. Wir konnten zudem zeigen, dass beide Kits die Wettbewerberprodukte übertreffen (siehe Abbildung „ Leistung des QIAwave-Kits“).
Mit dem QIAwave Plasmid Miniprep Kit lassen sich bis zu 20 μg Plasmid-DNA oder Cosmid-DNA in molekularbiologischer Qualität aufreinigen, um sie in molekularbiologischen Routineanwendungen wie PCR, Sequenzierung und Klonierung einzusetzen.
Die QIAprep 2.0 Spin Columns sind so vielseitig, dass sie in Mikrozentrifugen, auf Vakuumverteilern und auch auf QIAcube Connect verwendet werden können (siehe Abbildungen „Handhabungsoptionen A, D und E für QIAprep 2.0 Spin Columns“). Das Vakuumverfahren vereinfacht die Handhabung der Proben und beschleunigt deren Verarbeitung. Die QIAprep 2.0 Spin Columns können auch mit dem QIAvac 24 Plus oder einem anderen handelsüblichen Vakuumverteiler mit Luer-Anschlüssen verarbeitet werden. Das Extraktionsprotokoll kann auch mit QIAcube Connect vollständig automatisiert werden.
| Format | Spin-Säulen |
| Aufreinigungsmodul | QIAprep 2.0 Spin Columns |
| Durchsatz | 1–24 Proben |
| Vorbereitungszeit | 24 Minipräps in 30 Minuten |
| Erforderliche Arbeitsmittel | Mikrozentrifuge oder Vakuumverteiler; vollständig automatisierbar mit QIAcube Connect |
| Lysatbereinigung | Zentrifugation |
| Fassungsvermögen des Säulenreservoirs | 800 µl |
| Mindestvolumen des Elutionspuffers | 50 µl |
| Kulturvolumen für Plasmide mit hoher Kopienzahl | 1–5 ml |
| Kulturvolumen für Plasmide/Cosmide mit geringer Kopienzahl | 1–10 ml |
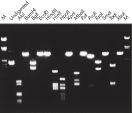
Aufgereinigte DNA kann für den Restriktionsaufschluss verwendet werden (siehe Abbildung „Vollständiger Aufschluss mit verschiedenen Restriktionsenzymen“).
Abbildungen ansehen
Prinzip
Die QIAprep 2.0 Spin Columns enthalten eine einzigartige Silikamembran, die bei Vorliegen einer hohen Konzentration an chaotropem Salz bis zu 20 μg DNA bindet und die Elution in einem kleinen Volumen salzarmen Puffers ermöglicht. Mit der QIAprep Membrantechnologie entfallen die zeitaufwändige Phenol-Chloroform-Extraktion und die Alkoholausfällung sowie die Probleme und Nachteile, die mit losen Harzen und Aufschlämmungen einhergehen. Die aus den QIAprep 2.0 Spin Columns eluierte hochreine Plasmid-DNA ist sofort einsatzbereit und muss nicht ausgefällt, konzentriert oder entsalzt werden.
Verfahren
Die Aufreinigung von DNA-Plasmiden mit dem QIAwave Plasmid Miniprep erfolgt nach dem einfachen Prinzip „Binden, Waschen, Eluieren“/“Bind-Wash-Elute" (siehe Flussdiagramm „ QIAwave Plasmid Miniprep Verfahren“).
1. Die Bakterienkulturen lysieren und die Lysate durch Zentrifugation bereinigen.
2. Die bereinigten Lysate in die QIAprep 2.0 Spin Columns einbringen. An diesem Punkt adsorbiert die Plasmid-DNA an der Silikamembran und Verunreinigungen werden weggewaschen.
3. Die reine DNA wird dann in einem kleinen Volumen Elutionspuffer oder Wasser eluiert.
Neben der Plasmidaufreinigung aus E. coli kann das QIAwave Plasmid Mini Kit auch zur Aufreinigung von Plasmid-DNA aus Saccharomyces cerevisiae, Bacillus subtilis und Agrobacterium tumefaciens verwendet werden. Sollten Sie Protokolle für diese Anwendungen benötigen, wenden Sie sich bitte an unser Team des technischen Kundendienstes oder an Ihren Händler vor Ort.
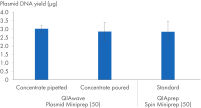
QIAwave Puffer werden als Konzentrate geliefert und lassen sich durch Zugabe von Wasser und/oder Ethanol leicht rekonstituieren; Einzelheiten entnehmen Sie bitte dem Handbuch. QIAwave QIAprep 2.0 Spin Columns und Waste Tubes werden einzeln verpackt geliefert und müssen vor Protokollbeginn vormontiert werden. Das kostet zwar etwas mehr Zeit, reduziert aber den Plastikmüll.
Liegen zu viele Proben für eine manuelle Bearbeitung vor, können Sie den Aufreinigungsprozess mit den DNeasy Mini Spin Prep-Säulen auf dem QIAcube Connect automatisieren.
Abbildungen ansehen
Anwendungen
Das QIAwave Plasmid Miniprep Kit liefert reproduzierbare Ausbeuten an hochreiner DNA, die sich für die meisten Anwendungen eignet, einschließlich:
- PCR
- Restriktionsverdau
- Ligation und Transformation
- Sequenzierung
- Screening
Ergänzende Daten und Abbildungen
QIAwave Plasmid Miniprep Kit performance
Specifications
| Features | Specifications |
|---|---|
| Applications | Fluoreszenz- und radioaktive Sequenzierung (einschließlich Kapillarsequenzierung), Ligation, Klonierung, Transformation etc. |
| Processing | Manuell (Zentrifugation oder Vakuum) |
| Plasmid type | High-Copy, Low-Copy, Cosmid-DNA |
| Culture volume/starting material | 1–10 ml Kulturvolumen |
| Elution volume | 50 µl (Minimum) |
| Technology | Silikatechnologie |
| Time per run or prep per run | <30 Minuten |
| Yield | <20 ug |
| Samples per run (throughput) | 1–24 Proben pro Lauf |
| Number of preps per run | 1–24 Proben pro Lauf |