Billes d’agarose magnétiques Ni-NTA
Pour la purification à petite échelle et haut débit des protéines marquées à l’histidine (His) et les dosages polyvalents avec capture magnétique à l’aide des His-tags
Pour la purification à petite échelle et haut débit des protéines marquées à l’histidine (His) et les dosages polyvalents avec capture magnétique à l’aide des His-tags
Les billes d’agarose magnétiques Ni-NTA sont des particules magnétiques recouvertes d’une matrice de purification par affinité de Ni-NTA Agarose. Elles permettent d’immobiliser et de purifier les protéines recombinantes contenant un His-tag. Les résidus d’histidine du His-tag se lient aux positions vacantes dans la sphère de coordination des ions nickel immobilisés avec une spécificité et une affinité élevées. Une fois les protéines liées, les billes peuvent être précipitées à l’aide d’un aimant, lavées puis les protéines sont éluées dans de petits volumes de tampon en conditions natives ou dénaturantes.
Le QIAexpress Ni-NTA Protein Purification System, associé aux billes d’agarose magnétiques Ni-NTA (voir l’illustration Micrographie des billes d’agarose magnétiques Ni-NTA), est basé sur la remarquable sélectivité de la résine brevetée Ni-NTA (Nickel-Acide nitrilotriacétique) pour les protéines contenant une étiquette d’affinité de six résidus d’histidine ou plus, le His-tag. Cette technologie permet une purification en une étape de quasiment toutes les protéines marquées à l’histidine à partir de n’importe quel système d’expression en conditions natives ou dénaturantes (voir l’illustration Purification des protéines à l’aide du système de purification des protéines Ni-NTA). Le NTA, qui présente quatre sites de chélation pour les ions nickel, lie le nickel plus étroitement que les systèmes de purification par chélation du métal, qui ne présentent que trois sites pour l’interaction avec les ions métalliques. Le site de chélation supplémentaire empêche la lixiviation des ions nickel et offre une plus grande capacité de liaison ainsi que des préparations des protéines d’une pureté supérieure à celle obtenue avec d’autres systèmes de purification par chélation du métal. Le système QIAexpress peut être utilisé pour purifier les protéines marquées à l’histidine à partir de n’importe quel système d’expression, y compris les baculovirus, les cellules de mammifères, les levures et les bactéries.
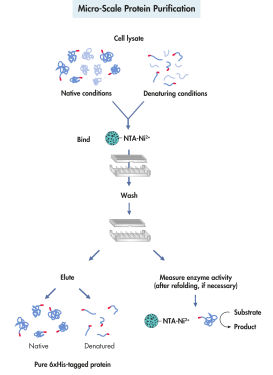
La purification des protéines marquées à l’histidine comprend 4 étapes : lyse cellulaire, liaison, lavage et élution (voir l’illustration Purification des protéines à micro-échelle). La purification des protéines recombinantes avec le système QIAexpress ne dépend pas de la structure tridimensionnelle de la protéine ou du His-tag. Cela permet une purification des protéines en une étape en conditions natives ou dénaturantes, à partir de solutions diluées et de lysats bruts. Vous pouvez utiliser des dénaturants et des détergents puissants pour une solubilisation et une purification efficaces des récepteurs, des protéines membranaires et des protéines qui forment les corps d’inclusion. Les réactifs qui permettent d’éliminer correctement les contaminants de liaison non spécifique peuvent être inclus dans les tampons de lavage (voir le tableau ci-dessous). Les protéines purifiées sont éluées en conditions modérées par l’ajout de 100 à 250 mM d’imidazole comme concurrent ou par la réduction du pH.
| Dénaturants | Détergents | Agents réducteurs | Autres | Sels | Pour une conservation de longue durée |
|---|---|---|---|---|---|
| Gu HCl 6 M | Triton X-100 2 % | β-ME 20 mM | Glycérol 50 % | MgCl2 4 M | Jusqu’à 30 % d’éthanol |
| Urée 8 M | Tween 20 2 % | DTT 10 mM | Éthanol 20 % | CaCl2 5 mM | ou NaOH 100 mM |
| CHAPS 1 % | TCEP 20 mM | Imidazole 20 mM | NaCl 2 M |
Le QIAexpress Ni-NTA Protein Purification System, associé aux billes d’agarose magnétiques Ni-NTA, permet une purification fiable en une étape des protéines, adaptée à de nombreuses applications, notamment :
| Features | Specifications |
|---|---|
| Applications | Protéomique |
| Processing | Automatisé/manuel |
| Yield | < 10 mg de protéine par colonne |
| Bead size | 20 à 70 µm |
| Support/matrix | Billes d’agarose magnétiques |
| Tag | 6xHis-tag |
| Special feature | Cadence élevée (96 puits) |
| Start material | Lysat cellulaire |
| Binding capacity | Jusqu’à 2 mg/ml de suspension (5 %) |
| Scale | Petite échelle |